Un total de 30 voluntarios recibirán en los próximos días la vacuna Hipra, la primera española contra la covid-19, en el marco del ensayo clínico que llevan a cabo profesionales del Hospital Clínic de Barcelona y del Josep Trueta de Girona
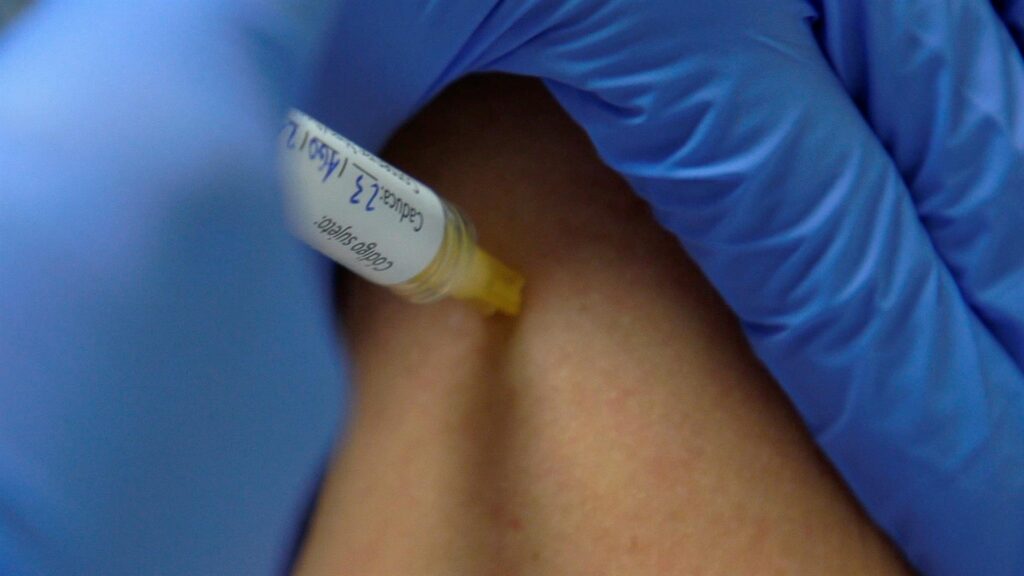
Tal como han explicado este viernes en rueda de prensa los responsables de ambos hospitales, el ensayo se encuentra actualmente en fase I/IIa y cuenta con 30 participantes -seis de los cuales ya han recibido la vacuna-, que han sido seleccionados de entre más de 400 voluntarios en una convocatoria que, según estos expertos, ha tenido una respuesta masiva.
En esta fase del estudio los profesionales analizarán principalmente la seguridad de la vacuna y su inmunogenicidad, es decir, la capacidad de generar una respuesta inmunitaria, para lo cual han escogido a 30 voluntarios de entre 18 y 39 años que no han sufrido la enfermedad ni han sido vacunados contra la covid-19 previamente.
«La respuesta de las personas ha sido impresionante. No esperaba que tuviéramos tanto éxito», ha destacado la investigadora principal del estudio y especialista del Servicio de Enfermedades Infecciosas del Clínic, Lorna Leal, mientras que el investigador del Instituto de Investigación Biomédica de Girona Dr. Josep Trueta (IDIBGI) Rafel Ramos ha puesto en valor la respuesta de la sociedad, dispuesta a «contribuir» para combatir la pandemia.
Recomiendan a los voluntarios evitar «situaciones de riesgo»
A los 30 voluntarios, a quienes se recomienda evitar «situaciones de riesgo» para no contagiarse durante el proceso, se les administrarán dos dosis de la vacuna separadas por 21 días, por lo que se ha escogido el suero de Pzifer como alternativo al Hipra para poder encajar los tempos del estudio.
De esta forma, cinco participantes serán inmunizados con Pzifer, mientras que los 25 restantes serán divididos en tres grupos, cada uno de los cuales recibirá una dosis distinta de la vacuna de Hipra. Las conclusiones del estudio servirán también para determinar la cantidad de suero ideal de cara a las próximas fases.
«Es un ensayo de dosis escalado, eso significa que vamos despacio en el proceso de seleccionar la dosis, por lo que empezamos con la más baja que se considera que puede ser eficaz y a partir de ahí se plantean otras diferentes», ha precisado Leal.
Se trata de un preparado proteico que simula una parte del virus y, cuando entra en el organismo, genera una respuesta inmunitaria que «queda como recuerdo», por lo que «si en algún momento el virus accede a nuestro cuerpo, tendremos defensas para actuar rápidamente y protegernos de la infección o de un cuadro clínico grave», ha detallado Ramos.
Este mecanismo, ha continuado Leal, le da «ciertas ventajas» a Hipra -cuyos laboratorios están en la localidad gerundense de Amer- respecto de otras vacunas ya comercializadas.
«Al ser una proteína recombinante hecha a base de dos subtipos de virus, en pruebas preclínicas ya se ha podido ver que funciona con las variantes de la covid-19 que conocemos. Ahora se deberá comprobar si en humanos también funciona», ha señalado Leal, quien ha aseverado que, gracias a esta tecnología, la vacuna de Hipra lo tendrá «más fácil» para «adaptarse a posibles nuevas variantes».
Por otro lado, ha aclarado la investigadora, han decidido llevar a cabo una pauta de primovacunación en lugar de probar la vacuna como tercera dosis en personas ya inmunizadas porque «es la mejor forma de demostrar su eficacia», aunque no será hasta fases posteriores cuando se valore «cuál es la mejor estrategia».
En este sentido, ha precisado que más adelante también se analizará si se puede contemplar para poblaciones aún no vacunadas, como niños, personas inmunodeprimidas o ancianos enfermos.
En cuanto a posibles efectos secundarios, Ramos ha asegurado que, por el momento, no han detectado «ningún aspecto relevante»: «Vamos por el buen camino», ha enfatizado.
La previsión es que el ensayo dure alrededor de un año, aunque en dos o tres meses ya se dispondrá de información «relevante» para saber si pueden continuar con las pesquisas, pese a lo cual han evitado precisar cuándo podría comercializarse la vacuna.
«Es muy difícil hablar de fechas. Queremos que sea lo antes posible, pero tiene que pasar por todas las fases del ensayo clínico (…) y después los filtros de la Agencia Europea del Medicamento».
«Aún es demasiado pronto», ha afirmado el jefe de Enfermedades infecciosas del Clínic, Àlex Soriano, antes de que la directora del IDIBGI, Marga Nadal, haya recalcado: «En investigación es muy importante ir paso a paso


